| Difenilzinco | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Difenilzinco | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12H10Zn |
| Massa molecolare (u) | 219.59 g/mol |
| Aspetto | Solido bianco |
| Numero CAS | |
| Numero EINECS | 214-082-2 |
| PubChem | 517896 |
| SMILES | C1=CC=[C-]C=C1.C1=CC=[C-]C=C1.[Zn+2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | 228 - 250 |
| Consigli P | 210 - 222 - 231 - 233 - 240 - 241 - 280 - 302+335+334 - 370+378 |
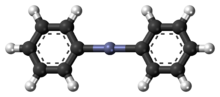
Il difenilzinco è un composto chimico di formula C12H10Zn che in condizioni normali si presenta come un solido bianco.[1] In sintesi organica, è utilizzato come reagente per funzionalizzare molecole con l'inserimento di un gruppo fenile, come può avvenire nella reazione di Michael, in cui svolge il complito di nucloefilo (cosiddetto donatore di Michael), o nella reazione di Neghishi.
Sintesi
[modifica | modifica wikitesto]Il difenilzinco è disponibile in commercio e, generalmente, lo si può sintetizzare con tre metodi differenti.
- Transmetallazione da un composto organico del litio. Viene condotta facendo reagire un alogenuro di zinco con il fenillitio in condizioni anidre. In letteratura sono riportati esempi con il cloruro di zinco[2] o con il bromuro di zinco.[3]
- Transmetallazione da un reattivo di Grignard. Viene condotta facendo reagire un alogenuro di zinco con un composto di Grignard. A titolo di esempio, è possibile citare la reazione sottostante tra il bromuro di fenilmagnesio e il cloruro di zinco.
- In accordo alla teoria HSAB, entrambe le reazioni di transmetallazione presentano l'equilibrio di reazione spostato verso la formazione dei prodotti.
- Ossidoriduzione con zinco metallico. Questo metodo prevede la formazione del composto tramite una reazione con buone rese a partire da difenilmercurio, che può reagire con un eccesso di zinco in diverse condizioni.[4][1] La formazione dei prodotti è favorita dal potenziale di riduzione del mercurio, notevolmente superiore a quello dello zinco: in acqua circa +0,8 V vs –0,74 V.
Caratteristiche strutturali e fisiche
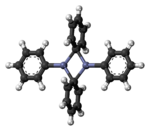
[modifica | modifica wikitesto]Il difenilzinco isolato esiste come dimero PhZn(μ-Ph)2ZnPh allo stato solido (e non solvatato).[5]
Il difenilzinco è un composto organico dello zinco ed è considerato l'equivalente sintetico di un sintone feniluro (Ph-).
La relativa stabilità del composto è dovuta all'impossibilità intrinseca di subire due reazioni di decomposizione tipiche invece degli alchili dei metalli di transizione: l'α–eliminazione di idruro metallico (a sua volta spesso instabile), poiché non ci sono idrogeni sul carbonio legato a Zn), e soprattutto la β–eliminazione, poiché produrrebbe un intermedio di natura benzinica estremamente instabile.
Il composto è infatti termicamente stabile (punto di ebollizione 280-285°alla pressione atmosferica di 760 mmHg), tuttavia è sensibile all'aria ed all'umidità.
Note
[modifica | modifica wikitesto]- ^ a b (EN) Guillaume Pelletier, Diphenylzinc, in Encyclopedia of Reagents for Organic Synthesis, Chichester, UK, John Wiley & Sons, Ltd, 2013, DOI:10.1002/047084289x.rn01548, ISBN 978-0-471-93623-7.
- ^ (EN) Julia E. Fleckenstein e Konrad Koszinowski, Lithium Organozincate Complexes LiRZnX 2 : Common Species in Organozinc Chemistry, in Organometallics, vol. 30, n. 18, 26 settembre 2011, pp. 5018–5026, DOI:10.1021/om200637s. URL consultato il 4 agosto 2024.
- ^ David Y. Curtin e John L. Tveten, Reaction of Diarylzinc Reagents with Aryldiazonium Salts. Direct Formation of cis-Azo Compounds, in J. Org. Chem., vol. 26, n. 6, 1961, pp. 1764, DOI:10.1021/jo01065a017.
- ^ P Markies, Gerrit Schat, Otto S. Akkerman, F. Bickelhaupt e Anthony L. Spek, Complexation of diphenylzinc with simple ethers. Crystal structures of the complexes Ph2Zn·glyme and Ph2Zn·diglyme, in J. Organomet. Chem., vol. 430, 1992, pp. 1–13, DOI:10.1016/0022-328X(92)80090-K.
- ^ Peter R. Markies, Gerrit Schat, Otto S. Akkerman, Friedrich Bickelhaupt, Wilberth J. J. Smeets e Anthony L. Spek, Coordinational behavior of solvent-free diorganylzinc compounds: the remarkable x-ray structure of dimeric diphenylzinc, in Organometallics, vol. 9, n. 8, 1990, pp. 2243, DOI:10.1021/om00158a022.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Difenilzinco
Wikimedia Commons contiene immagini o altri file su Difenilzinco