 | |||||||||
| Identificadors | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número EC | 2.7.7.49 | ||||||||
| Bases de dades | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| Estructures PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
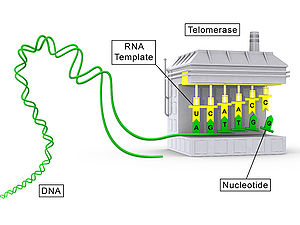
La telomerasa és un enzim que afegeix una seqüència específica d'ADN que es repeteix ("TTAGGG" en tots els vertebrats) a l'extrem 3' de les cadenes d'ADN en les regions dels telòmers, presents als extrems dels cromosomes eucariotes. Els telòmers contenen material d'ADN condensat, proporcionant així estabilitat als cromosomes. Com a enzim, la telomerasa és una transcriptasa inversa que porta la seva pròpia molècula d'ARN, ja que aquesta serà utilitzada com a plantilla a l'hora d'allargar els telòmers, que són més curts després de cada cicle de replicació.
L'existència d'un mecanisme de compensació de l'escurçament de telòmers va ser enunciada pel biòleg soviètic Aleksei Olovnikov el 1973;[1] l'investigador també va suggerir la hipòtesi de l'envelliment cel·lular basada en l'escurçament dels telòmers i les relacions del telòmer amb el càncer. La telomerasa va ésser descoberta per Carol W. Greider i Elizabeth Blackburn el 1985 en el ciliat Tetrahymena.[2] Juntament amb Jack W. Szostak, Greider i Blackburn van ser guardonats amb el Premi Nobel de Medicina o Fisiologia el 2009 pel seu descobriment.[3]
En els darrers anys s'ha proposat la possibilitat que la telomerasa sigui una resta evolutiva d'un ribozim que va servir anteriorment per a catalitzar la síntesi d'ADN; és a dir, podria haver estat un intermediari en la transició evolutiva des de les ARN replicases fins a les transcriptases inverses proteiques.[4] També se n'ha proposat un possible origen retrovíric.[5]
Estructura
[modifica]
La composició proteica de la telomerasa humana va ser identificada el 2007 per Scott Cohen i el seu equip del Children's Medical Research Institute d'Austràlia. Es compon de tres molècules diferents: la transcriptasa inversa (TERT), la telomerasa ARN (TR o TERC) i disquerina (DKC1).[6] Els gens codificants de les subunitats de la telomerasa, que són TERT, TERC, DKC1 i TEP1,[7] etc., es troben en els diferents cromosomes del genoma humà. En concret, el gen humà TERT (hTERT) es tradueix en una proteïna de 1.132 aminoàcids. Les proteïnes TERT han estat seqüenciades en molts organismes eucariotes;[8] aquest polipèptid es plega amb el TERC, un ARN no codificant de 451 nucleòtids de llargària en humans. El TERT té una estructura de "guant" que li permet embolicar el cromosoma per afegir-hi una única cadena repetidora de telòmer.
La TERT és una transcriptasa inversa, és a dir, un tipus d'enzim que dona lloc a una única cadena d'ADN a partir d'una sola cadena d'ARN com a motllo. Els enzims d'aquesta classe (no el TERT especialment, però sí els que són aïllats a partir de virus) són utilitzats pels científics en el procés molecular de la reacció en cadena de la polimerasa amb transcriptasa inversa (RT-PCR), que permet la formació de moltes còpies d'ADN d'una seqüència objectiu utilitzant ARN com a motlle retrotranscriptiu. Com s'ha indicat anteriorment, la TERT porta al voltant el seu propi patró de retrotranscripció, la TERC.
L'estructura de la subunitat catalítica de la proteïna Tribolium casteneum de la telomerasa TERT va ser definida per Skordalakes Emmanuel i el seu equip de l'Institut Wistar, a Filadèlfia.[9] L'estructura en alta resolució va revelar que la proteïna consta de quatre dominis conservats (RNA-Binding Domain (Trbd)), organitzades en una configuració d'anell, que comparteix característiques comunes amb antiretrovirals de transcriptasa inversa, amb RNA polimerases virals i amb ADN polimerases bacteriòfagues de la familia B.

Mecanisme de funcionament
[modifica]En el mecanisme de replicació de l'ADN en cromosomes eucariotes (linears) ens trobem amb un problema: no hi ha espai per produir el primer d'ARN que es necessita per començar el següent fragment d'Okazaki just a la punta d'una molècula d'ADN linear.
La resolució d'aquest problema es troba en el fet que els eucariotes posseeeixen seqüències de nucleòtids especialitzades al final dels seus cromosomes que estan agrupades en les estructures denominades telòmers. Els telòmers contenen moltes repeticions d'una seqüència molt curta que és similar en organismes molt diversos (fongs, protozous, plantes i mamífers). En humans, aquesta seqüència és una TTAGGG, i es repeteix al voltant de mil vegades per cada telòmer.
Són aquestes seqüències que són reconegudes per mitjà d'unions específiques amb les telomerases, que s'encarrega de reomplir aquestes seqüències cada vegada que la cèl·lula es divideix. La telomerasa reconeix el principi d'una de les seqüències telomèriques repetitives i l'allarga en direcció 5'--3', utilitzant un patró d'ARN que duu incorporat en la seva pròpia estructura. La porció enzimàtica de la telomerasa uneix altres transcriptases inverses, enzims que sintetitzen ADN utilitzant un patró d'ARN.
En aquest procés, en l'extrem del cromosoma es forma una estructura coneguda com a t-loop, que proveeix als extrems dels cromosomes amb una estructura única que els protegeix dels enzims degradatius i els distingeix clarament dels finals de molècules d'ADN fragmentades que la cèl·lula té mecanismes per reparar de forma immediata[10]
Aquest procés es duu a terme per mitjà de les seqüències TERC i TERT; la regió motlle de TERC és is 3'-CAAUCCCAAUC-5'.[11] D'aquesta manera, la telomerasa pot unir els primers nucleòtids del motllo amb la darrera seqüència del telòmer en el cromosoma, afegir una nova seqüència de repetició de telòmers (5'-GGTTAG-3'), deixar anar, realiniar el nou extrem 3’ dels telòmers de la plantilla, i després repetir el procés.

Regulació de la longitud dels telòmers
[modifica]L'extrem d'un cromosoma conté un nombre variable de repeticions telomèriques. Un gran nombre d'experiments han demostrat que les cèl·lules que proliferen de forma indefinida tenen mecanismes homeostàtics que mantenen aquest nombre de repeticions en un determinat rang.
Avui dia, es proposa que en les cèl·lules somàtiques humanes les repeticions telomèriques proveeixen a cada cèl·lula amb un mecanisme de comptabilitat que les ajuda a prevenir la proliferació incontrolada de cèl·lules en teixits adults. Teòricament, aquest mecanisme hauria de controlar el creixement de cèl·lules anormals en els nostres òrgans, proporcionant-nos d'aquesta manera una protecció natural contra el càncer.
La idea que un telòmer actuï com a instrument de mesura de les divisions cel·lulars i, per tant, del temps de vida de la cèl·lula relaciona els mecanismes de la telomerasa amb mecanismes com l'apoptosi o mort cel·lular programada.[10]
Situacions fisiològiques i patològiques
[modifica]Telomerasa i senescència cel·lular
[modifica]- L'enzim telomerasa permet el reemplaçament de petits segments d'ADN coneguts com a telòmers, que són els que es van perdent a mesura que la cèl·lula experimenta divisions mitòtiques.[12]
En circumstàncies normals, sense la presència de telomerasa, si una cèl·lula es divideix de manera recurrent, en algun moment tots els seus descendents assoliran el seu límit de Hayflick, un punt en què deixaran de tenir la capacitat de realitzar la mitosi i reproduir-se.[13] Amb la presència de telomerasa, cada cèl·lula en divisió pot reemplaçar el pocs segments perduts d'ADN en cada cicle cel·lular, i qualsevol cèl·lula es pot dividir de forma indefinida. Si bé aquesta propietat de creixement sense límits ha entusiasmat a molts investigadors, la precaució es justifica en l'explotació d'aquesta propietat, ja que exactament aquest mateix creixement sense límits constitueix la mateixa base del comportament de les cèl·lules canceroses.
- Les cèl·lules mare embrionàries expressen la telomerasa, que els permet dividir-se en diverses ocasions de forma individual. En els adults, la telomerasa està altament expressada en cèl·lules que la necessiten per dividir-se de forma regular (per exemple, en el sistema immunològic), mentre que la majoria de les cèl·lules somàtiques l'expressen només en nivells molt baixos en un cicle cel·lular dependent.
- Una certa varietat de síndromes d'envelliment prematur s'associen amb telòmers curts.[14] Entre aquests hi ha la síndrome de Werner, la síndrome de Louis-Bar (atàxia-telangièctasi),[15] la síndrome de Bloom, l'anèmia de Fanconi i la síndrome de Nijmegen.[16] Els gens que han mutat en aquestes malalties tenen, en condicions normals, funcions en la reparació de danys en l'ADN i les seves funcions concretes en el manteniment de longitud dels telòmers és una àrea activa de recerca. Si bé en l'actualitat no es coneix en quina mesura l'erosió dels telòmers contribueix al procés d'envelliment normal, el manteniment de l'ADN en general i dels telòmers d'ADN en particular són considerats els factors fonamentals. El Dr. Michael Fossel ha suggerit, fins i tot, que les futures teràpies basades en la telomerasa poden ser utilitzades no únicament per combatre el càncer, sinó també per arribar a controlar l'envelliment humà i estendre la vida de manera significativa. Considera que els assajos en humans amb telomerasa basats en les teràpies per estendre la vida útil es desenvoluparan durant els 10 anys vinents.
- Alguns experiments han plantejat preguntes relacionades amb la possibilitat que la telomerasa sigui emprada com a teràpia d'anti-envelliment; s'ha vist, però, que ratolins amb alts nivells de telomerasa en les cèl·lules pateixen processos cancerígens i, per tant, la seva vida és escurçada i no allargada. A més, encara que certes síndromes d'envelliment prematur s'han associat amb l'escurçament dels telòmers, els ratolins sense telomerasa activa no semblen patir envelliment prematur. S'ha observat, doncs, que la telomerasa afavoreix processos de tumorogénesis, donant lloc a preguntes sobre el seu potencial com a teràpia d'anti-envelliment.[17] D'altra banda, un estudi va demostrar que l'activació de la telomerasa en ratolins resistents al càncer per sobreexpressió de la subunitat catalítica n'allargava la vida útil.[18]
- Des de 2007, s'han descobert diversos compostos que fan que les cèl·lules somàtiques expressin nivells més alts de telomerasa del normal. L'abril de 2007, Geron Corporation va llicenciar a la companyia New York-based TA Sciences amb l'assistència tècnica per dur a terme assaigs amb éssers humans en una molècula anomenada TA-65, un derivat de la planta Astragalus propinquus, que actua com activador de la telomerasa.[19] El novembre de 2007, Sierra Sciences va anunciar que havia descobert un compost anomenat C0057684 que va causar l'expressió dels nivells més alts d'activitat de la telomerasa en les cèl·lules somàtiques[20] i, el 2009, van anunciar que havien descobert uns altres 62 compostos que causaven l'activació de la telomerasa.[21]
Un estudi publicat el 2010, que es va centrar en jueus asquenazites, va trobar que aquells que havien viscut més havien heretat una versió hiperactiva de la telomerasa que reconstrueix els telòmers amb gran rapidesa i de forma quasi total.[22]
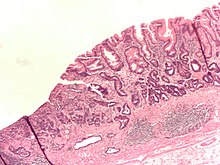
Telomerasa i càncer
[modifica]- Quan les cèl·lules s'aproximen al límit de Hayflick en cultius cel·lulars, el temps d'envelliment pot ser prorrogat per la inactivació de les proteïnes supressores tumorals - TP53 i la proteïna retinoblastoma (PRB). Les cèl·lules que han estat alterades pel temps se sotmetran a un esdeveniment denominat "crisi" quan la majoria de les cèl·lules en el cultiu moren. De vegades, una cèl·lula no deixa de dividir-se una vegada que arriba la crisi. En una situació típica, els telòmers es perden, i la integritat dels cromosomes disminueix amb cada divisió cel·lular posterior. Els extrems dels cromosomes exposats són interpretats com a trencaments de doble cadena (OSD) en l'ADN, el dany sol ser reparat per tornar a connectar (relligament) els extrems trencats. Quan la cèl·lula fa això a causa de l'escurçament dels telòmers, els extrems dels cromosomes diferents poden ser units. Això resol temporalment el problema de la falta de telòmers, però, durant l'anafase de la divisió cel·lular, els cromosomes fusionats són trencats a l'atzar, causant un gran nombre de mutacions i anomalies cromosòmiques. Com que aquest procés continua, el genoma de la cèl·lula es torna inestable. Finalment, es farà tant de mal als cromosomes de la cèl·lula de tal manera que la cèl·lula morirà (a través de la mort cel·lular programada, apoptosi), o es durà a terme una mutació addicional que activa la telomerasa.
- Amb l'activació de la telomerasa, alguns tipus de cèl·lules i els seus descendents es converteixin en immortals, és a dir, els cromosomes no es tornaran inestables, per moltes divisions cel·lulars se sotmeti (no es dona el límit de Hayflick), evitant així la mort cel·lular, sempre que les condicions per a la seva duplicació es compleixen. Moltes cèl·lules canceroses es consideren "immortals", perquè l'activitat de la telomerasa els permet dividir-se pràcticament per sempre, de manera que poden formar tumors. Un bon exemple de la immortalitat de les cèl·lules del càncer són les cèl·lules HeLa, que han estat utilitzades en els laboratoris com una línia cel·lular de model des del 1951. De fet, són considerades cèl·lules immortals - la producció diària de les cèl·lules HeLa s'estima en diverses tones.
- Si bé aquest mètode de modelatge de càncer humà en cultiu cel·lular és eficaç i s'ha utilitzat durant molts anys pels científics, també és molt imprecís. Els canvis exactes que permeten la formació dels clons tumorals en l'experiment descrit anteriorment no són clars. Posteriorment, els científics han estat capaços d'abordar aquesta qüestió amb la introducció d'una sèrie de mutacions presents en una gran varietat de càncers humans. Això ha portat a l'elucidació de les diverses combinacions de mutacions que són suficients per a la formació de cèl·lules oncogèniques, en diversos tipus de cèl·lules. Mentre que la combinació pot variar depenent del tipus de cèl·lula, un aspecte comú és que les alteracions requereixen el següent: l'activació de TERT, la pèrdua de la funció de la via p53, la pèrdua de la funció de la via de PRB, l'activació de Ras o protooncògens MYC,[23] i la d'una proteïna fosfatasa, la PP2A. És a dir, la cèl·lula té una telomerasa activa, i això provoca una sèrie d'esdeveniments en cadena a nivell de material genètic que tenen com a resultat l'eliminació del procés de la mort per inestabilitat o pèrdua cromosòmica, l'absència de vies d'inducció de l'apoptosi i l'activació contínua de la mitosi.
- Aquest model de càncer en cultius cel·lulars descriu amb precisió el paper de la telomerasa en els tumors humans reals. L'activació de la telomerasa s'ha observat en aproximadament un 90% de tots els tumors humans, cosa que suggereix que la immortalitat conferida per la telomerasa té un paper clau en el procés de desenvolupament del càncer. Dels tumors en què no s'ha activat la TERT,[24] la majoria ha trobat un camí diferent per mantenir la longitud dels telòmers anomenat ALT' (allargament alternatiu dels telòmers).[25] El mecanisme exacte que es troba darrere del manteniment dels telòmers en la via d'ALT no s'ha dilucidat, però sembla que involucra múltiples esdeveniments de recombinació al telòmer.

Relació entre telomerasa i patologies minoritàries
[modifica]D'acord amb el treball realitzat per Elizabeth Blackburn et al., altres papers de la telomerasa en el nostre organisme inclouen la sobrerregulació de 70 gens associats al creixement i metàstasi de càncers, així com l'activació de la glicogenòlisi, que permet a les cèl·lules canceroses d'utilitzar ràpidament els glúcids presents en l'organisme per tal de facilitar la seva taxa programada de creixement.
Recentment, les imatges de cèl·lules de càncer de còlon visualitzades mitjançant tècniques de microscopia per E.V Gostjeva et al. han estat comparades amb les cèl·lules del colon fetal, i s'ha vist que comparteixen moltes de les seves característiques.
Alguns estudis d'Elizabeth Blackburn et al. revelen que les mares amb fills que pateixen malalties molt greus posseeixen telòmers més curts quan afirmen que es troben en el nivell més elevat d'estrès. S'ha descobert també que hi ha telomerasa activa en llocs de bloqueig del teixit coronari arterial; aquest fet explicaria la raó per la qual els atacs cardíacs poden donar-se de forma sobtada, ja que se'n desprèn que la telomerasa condueix el creixement del bloqueig.
És més destacat, però, el paper significatiu dels mecanismes de funcionament de la telomerasa pel que fa a certes patologies genètiques de baixa prevalença.
Tres malalties humanes, la disqueratosis congènita (DKC),[26] l'anèmia aplàstica (AA) i la fibrosi pulmonar idiopàtica (FPI), s'han lligat a mutacions en els gens que codifiquen per als dos components essencials de la telomerasa, la telomerasa ARN (TR) i la telomerasa transcriptasa inversa (TERT).
Hi ha una sèrie de mutacions heterogènies que mostren que ni tan sols la meitat de la dosi de la telomerasa és suficient per mantenir la longitud dels telòmers, el que resulta en erosió i la pèrdua de la funció, la senescència i, en darrera instància, l'apoptosi. El manteniment de la longitud dels telòmers en les cèl·lules amb molta proliferació, i les cèl·lules mare de línia germinal, és crucial per a la preservació de les poblacions elevades i de la salut humana. En general, les mutacions puntuals, que condueixen a la substitució d'un sol aminoàcid, es toleren millor en els organismes vius que les mutacions i canvis del marc de la unió d'acoblament, que poden comportar una limitació o supressió de l'activitat de la telomerasa.
La tolerància de la reducció i pèrdua de la funció de la telomerasa disminueix amb cada generació posterior. Aquesta anticipació, o la progressió dels símptomes en la propera generació, és característic de les malalties telomeràsiques de deficiència. Els telòmers de la generació dels pares s'erosionen i quan passen a la seva descendència comença aquesta generació amb telòmers més curts. L'augment en la severitat dels símptomes es relaciona amb la disminució progressiva de la longitud dels telòmers.
- L'anèmia aplàstica (AA) és típicament una malaltia adquirida, tot i que hi ha casos poc comuns de formes constitutives de la malaltia que es troben en pacients amb una història familiar forta de diverses malalties de la sang. La malaltia s'ha relacionat amb mutacions en els gens que codifiquen TR i TERT. Aquesta forma constitutiva de la insuficiència de la medul·la òssia es defineix pels baixos recomptes de cèl·lules perifèriques a la sang; es dona així un cas de medul·la òssia hipocel·lular que no respon al tractament immunosupressor, i inclou típiques anomalies físiques. El constitutiu s'ha associat amb els pacients amb DKC, tot i que hi ha casos en què els símptomes no inclouen DKC. La causa més comuna de mort es deu a insuficiència en el funcionament de la medul·la òssia. (Fogarty et al, 2003).
- La fibrosi pulmonar idiopàtica (FPI) és una forma específica de la fibrosi pulmonar de causa desconeguda. La fibrosi pulmonar és una patologia que implica lesió fibròsica i cicatrització dels pulmons. L'acumulació de teixit de cicatrització en excés dona com a resultat una reducció del volum pulmonar. Els símptomes que caracteritzen la malaltia són la tos crònica i la dificultat per respirar. Alguns tipus familiars de la FIP són causats per mutacions en els gens que codifiquen TR i TERT.[27]
- La disqueratosi congènita (DKC) és una malaltia de la medul·la òssia que pot ser causada per diverses mutacions en les subunitats de les telomerases.[28] El 35% d'aquests casos están relacionats amb un gen recessiu del cromosoma X en el locus DKC1[29] i el 5% són autosòmics dominants, en el locus de TERT[30] i el del TERC.[31] Pacients amb DKC pateixen una fallida severa de la medul·la òssia que es manifesta en una pigmentació anormal, leucoplàsia (un enduriment blanquinós de la mucosa bucal) i distrofia ungular, així com una gran varietat d'altres símptomes. S'ha comprovat que individus amb qualsevol de les dues mutacions anteriorment descrites tenen telòmers més curts i activitat telomerasa deficient si els comparem amb altres individus de la mateixa edat.[32] S'ha donat fins i tot el cas d'una família en què una DKC de caràcter autosòmic dominant ha estat associada a una mutació heterozigòtica en la TERT.[33] Aquests pacients exhibeixen també un augment de la tasa d'escurçament de les telomerasa, así com una anticipació genètica que fa que el fenotip empitjori amb cada generació. En general, podem dir que aquesta síndrome pot donar-se a conseqüència de defectes genètics de diferent tipus, però sempre associats a l'activitat de les telomerases.
- La síndrome del miol de gat (CdCS) és una altra patologia associada als mecanismes d'allargament dels telòmers. Es tracta d'un trastorn de gran complexitat causat per la pèrdua de la regió distal del braç curt del cromosoma 5. TERT està localitzada en la regió que ha patit la deleció, i la pèrdua d'aquesta única còpia de TERT ha estat suggerit com a causa o factor contributiu d'aquesta malaltia.[34]

Investigació i desenvolupament de fàrmacs
[modifica]El cáncer és una malaltia complicada de combatre pel mateix cos, ja que el sistema immunològic té problemes reconeixent-la, i les cèl·lules canceroses són immortals, és a dir, es poden continuar dividint. La telomerasa és necessària per a la divisió infinita de les cèl·lules de molts tipus de càncer, de manera que es considera una diana potencial per fàrmacs inhibidors de la mitosi. Si una droga pogués ésser emprada per desactivar la telomerasa en les cèl·lules canceroses, el procés de l'escurçament dels telòmers finalitzaria, de manera que la longitud dels telòmers s'hauria perdut però les cèl·lules continuarien dividint-se; les mutacions serien freqüents i l'estabilitat cel·lular disminuiria.
S'han realitzat un gran nombre de proves amb fàrmacs i vacunes experimentals que marcaven la telomerasa en ratolins, i alguns d'ells han passat a l'etapa d'assaig preclínic, i Geron Corporation està, actualment, conduint quatre assajos clínics amb humans que involucren la inhibició de la telomerasa i vacunes contra la telomerasa. La plataforma de vacunació està essent provada utilitzant tres aproximacions diferents: una vacuna està basada en adenovirus o plàsmids, una altra està basada en una cèl·lula dendrítica i la darrera en una cèl·lula embrionària (aquesta es troba en estadi preclínic). Aquests mètodes de vacunació pretenen mostrar al sistema immunològic humà a atacar cèl·lules canceroses mitjançant l'expressió de la telomerasa. A més a més, l'ús de la droga inhibidora de la telomerasa es troba en tres assajos clínics d'estadi primerencs, i s'ha pogut comprovar que la inhibició de latelomerasa en molts tipus de cèl·lules neoplàsiques en cultiu ha portat a la mort massiva de la població cel·lular.
Tot i que aquestes teràpies són d'una gran complexitat, el fàrmac abans esmentat, desenvolupat a l'hospital John Hopkins, s'uneix directament al patró d'ARN de la telomerasa; la més mínima mutació provocaria que la telomerasa fos incapaç d'estendre els telòmers i, per tant, incapaç de proporcionar a les cèl·lules canceroses immortalitat replicativa, de permetre l'inici de la glicogenòlisi i de sobrerregular els 70 gens del càncer de Blackburn. Partint de la base que Blackburn ha demostrat que la majoria dels efectes més perjudicials relacionats amb el càncer de la telomerasa depenen d'un patró d'ARN intacte, aquesta semblaria ser una diana vàlida en referència al desenvolupament de fàrmacs.[35]
Si, efectivament, algunes cèl·lules canceroses empressin un mètode alternatiu de manteniment de la telomerasa, caldria tenir en compte que moren de totes maneres quan el patró d'ARN de la telomerasa es bloqueja; això proporciona esperances als investigadors pel que fa a la teràpia gènica que permeti prevenir de forma efectiva certs tipus de càncer i altres patologies provocades per defectes en l'activitat de les telomerases.
Referències
[modifica]- ↑ [Olovnikov AM. A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon. J Theor Biol. 1973 Sep 14;41(1):181-90]
- ↑ Greider, CW; Blackburn, EH «Identification of a specific telomere terminal transferase activity in Tetrahymena extracts» (en anglès). Cell, 1985 Des; 43 (2 Pt 1), pp: 405–413. ISSN 0092-8674. DOI: 10.1016/0092-8674(85)90170-9. PMID: 3907856 [Consulta: 7 setembre 2020].
- ↑ The Nobel Prize. «The Nobel Prize in Physiology or Medicine 2009» (en anglès). Press release, 05-10-2020. [Consulta: 7 setembre 2020].
- ↑ Luque Cabrera, J; Herráez Sánchez, A «Texto ilustrado de Biología Molecular e Ingeniería Genética: Conceptos, técnicas y aplicaciones en ciencias de la salud» (en castellà). Elsevier España, 2001; Gen, pàgs: 492. ISBN 9788481745054.
- ↑ Witzany, G «The Viral Origins of Telomeres and Telomerases and their Important Role in Eukaryogenesis and Genome Maintenance» (en anglès). Biosemiotics, 2008 Jul 23; 1 (2), pp: 191–206. ISSN 1875-1342. DOI: 10.1007/s12304-008-9018-0 [Consulta: 7 setembre 2020].
- ↑ Cohen S, Graham M, Lovrecz G, Bache N, Robinson P, Reddel RR «Protein composition of catalytically active human telomerase from immortal cells» (en anglès). Science, 2007 Mar 30; 315 (5820), pp: 1850-1853. ISSN 1095-9203. DOI: 10.1126/science.1138596. PMID: 17395830 [Consulta: 16 setembre 2020].
- ↑ HUGO Gene Nomenclature Committee(HGNC)
- ↑ NCBI - telomerase reverse transcriptase
- ↑ "Structure of the Tribolium castaneum telomerase catalytic subunit TERT", Nature 455 (7213): 633–637 Gillis, A. J.; Schuller, A. P. & Skordalakes, E. (2008),
- ↑ 10,0 10,1 [Molecular Biology of The Cell, Fifth Edition] Alberts, Johnson, Lewis, Raff, Roberts, Walter.
- ↑ Gavory, G; Farrow, M; Balasubramanian, S «Minimum length requirement of the alignment domain of human telomerase RNA to sustain catalytic activity in vitro» (en anglès). Nucleic Acids Res, 2002 Oct 15; 30 (20), pp: 4470-4480. PMID: 12384594. DOI: 10.1093/nar/gkf575. PMC: 137139 [Consulta: 5 setembre 2020].
- ↑ Liu, J; Wang, L; Wang, Z; Liu, JP «Roles of Telomere Biology in Cell Senescence, Replicative and Chronological Ageing» (en anglès). Cells, 2019 Gen 15; 8 (1), pp: 54. PMID: 30650660. DOI: 10.3390/cells8010054. PMC: 6356700 [Consulta: 16 setembre 2020].
- ↑ Hayflick, L; Moorhead, PS «The serial cultivation of human diploid cell strains» (en anglès). Exp Cell Res, 1961 Des; 25, pp: 585-621. ISSN 0014-4827. DOI: 10.1016/0014-4827(61)90192-6. PMID: 13905658 [Consulta: 7 setembre 2020].
- ↑ Blasco, MA «Telomeres and human disease: ageing, cancer and beyond» (en anglès). Nat Rev Genet, 2005 Ag; 6 (8), pp: 611-622. ISSN 1471-0056. DOI: 10.1038/nrg1656. PMID: 16136653 [Consulta: 28 febrer 2020].
- ↑ Delfino, M; Bruzzone, R; Rey, A; Delfino, A; Pírez, MC «Ataxia-telangiectasia (síndrome de Louis-Bar)» (en castellà). Arch Pediatr Urug, 2006 Jun; 77 (2), pp: 154-158. ISSN 1688-1249 [Consulta: 7 setembre 2020].
- ↑ Chrzanowska, KH; Gregorek, H; Dembowska-Bagińska, B; Kalina, MA; Digweed, M «Nijmegen breakage syndrome (NBS)» (en anglès). Orphanet J Rare Dis, 2012 Feb 28; 7, pp: 13. PMID: 22373003. DOI: 10.1186/1750-1172-7-13. PMC: 3314554 [Consulta: 7 setembre 2020].
- ↑ de Magalhaes JP, Toussain O «Telomeres and telomerase: a modern fountain of youth?» (en anglès). Rejuvenation Res, 2004 Estiu; 7 (2), pp: 126-133. ISSN 1549-1684. DOI: 10.1089/1549168041553044. PMID: 15312299 [Consulta: 17 setembre 2020].
- ↑ Tomás-Loba A, Flores I, Fernández-Marcos PJ, Cayuela ML, Maraver A, Tejera A, Borrás C, Matheu A, Klatt P, Flores JM, Viña J, Serrano M, Blasco MA «Telomerase reverse transcriptase delays aging in cancer-resistant mice» (en anglès). Cell, 2008 Nov 14; 135 (4), pp: 609-622. ISSN 1097-4172. DOI: 10.1016/j.cell.2008.09.034. PMID: 19013273 [Consulta: 6 setembre 2020].
- ↑ Harley, CB; Liu, W; Blasco, M; Vera, E; et al «A Natural Product Telomerase Activator As Part of a Health Maintenance Program» (en anglès). Rejuvenation Res, 2011 Feb; 14 (1), pp: 45-56. PMID: 20822369. DOI: 10.1089/rej.2010.1085. PMC: 3045570 [Consulta: 7 setembre 2020].
- ↑ Tanglao, Shawna, et al. (2008) [The Discovery of C0057684, a Telomerase Activity Inducing Compound.]The Methuselah Foundation.
- ↑ Sierra Sciences (2009).[Cure Aging or Die Trying|http://www.sierrasci.com/splash.html Arxivat 2009-12-16 a Wayback Machine.]
- ↑ Atzmon, G; Cho, M; Cawthon, RM; Budagov. T; et al «Genetic variation in human telomerase is associated with telomere length in Ashkenazi centenarians» (en anglès). Proc Natl Acad Sci USA, 2010 Gen 26; 107 (Supl 1), pp: 1710. PMID: 19915151. DOI: 10.1073/pnas.0906191106. PMC: 2868292 [Consulta: 16 setembre 2020].
- ↑ Genetics Home Reference «MYC gene» (en anglès). NIH, US National Library of Medicine, 2020; Ag 17 (rev), pàgs: 3. Arxivat de l'original el 3 de setembre 2020 [Consulta: 16 setembre 2020].
- ↑ Bryan TM, Englezou A, Gupta J, Bacchetti S, Reddel RR «Telomere elongation in immortal human cells without detectable telomerase activity» (en anglès). EMBO J, 1995 Set 1; 14 (17), pp: 4240-4248. ISSN 0261-4189. PMC: 394507. PMID: 7556065 [Consulta: 16 setembre 2020].
- ↑ Henson JD, Neumann AA, Yeager TR, Reddel RR (2002). "Alternative lengthening of telomeres in mammalian cells
- ↑ Savage, S «Disqueratosis congènita» (en castellà). Orphanet, 2019 Ag; ORPHA:1775 (rev), pàgs: 5 [Consulta: 17 setembre 2020].
- ↑ Bilgili, H; Białas, AJ; Górski, P; Piotrowski, WJ «Telomere Abnormalities in the Pathobiology of Idiopathic Pulmonary Fibrosis» (en anglès). J Clin Med, 2019 Ag 16;8 (8), pp: 1232. PMID: 31426295. DOI: 10.3390/jcm8081232. PMC: 6723768 [Consulta: 16 setembre 2020].
- ↑ Yamaguchi H (2007). "Mutations of telomerase complex genes linked to bone marrow failures" (PDF).[Enllaç no actiu] J Nippon Med Sch. 74 (3): 202-9.
- ↑ Heiss NS, Knight SW, Vulliamy TJ et al. (1998).[|"X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions".] Nat Genet. 19 (1): 32-8
- ↑ Vulliamy TJ, Walne A, Baskaradas A et al. (2005)[hhttp://www.ncbi.nlm.nih.gov/pubmed/15885610|Mutations in the reverse transcriptase component of telomerase (TERT) in patients with bone marrow failure". Blood Cells Mol Dis. 34 (3): 257-63.]
- ↑ Vulliamy T, Marrone A, Goldman F et al. (2001). "The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita" Nature 413 (6854): 432-5.
- ↑ Marrone, A.; Walne, A. & Dokal, I. (2005), "Dyskeratosis congenita: telomerase, telomeres and anticipation",Current Opinion in Genetics & Development 15 (3): 249–257
- ↑ Armanios, M.; Chen, J. L.; Chang, Y. P.; Brodsky, R. A.; Hawkins, A.; Griffin, C. A.; Eshleman, J. R.; Cohen, A. R.; et al «Haploinsufficiency of telomerase reverse transcriptase leads to anticipation in autosomal dominant dyskeratosis congenita» (en anglès). Proc Natl Acad Sci USA, 2005 Nov 1; 102 (44), pp: 15960–15964. PMID: 16247010. DOI: 10.1073/pnas.0508124102. PMC: 1276104 [Consulta: 6 setembre 2020].
- ↑ Zhang, A; Zheng, C; Hou, M; Lindvall, C; Li, K; et al «Deletion of the telomerase reverse transcriptase gene and haploinsufficiency of telomere maintenance in Cri du chat syndrome» (en anglès). Am J Hum Genet, 2003 Abr; 72 (4), pp: 940–948. PMID: 12629597. DOI: 10.1086/374565. PMC: 1180356 [Consulta: 16 setembre 2020].
- ↑ "Telomeres and telomerases as drug targets" Evonne M. Rezlera, David J. Bearssb and Laurence H. Hurley
Bibliografia
[modifica]- Collins, Kathleen; Mitchell, James R. Telomerase in the human organism (en anglès). Oncogene, 2002 Gen 21; 21 (4), pp: 564-579. PMID: 11850781. DOI 10.1038/sj.onc.1205083 [Consulta: 16 setembre 2020].
- Tsoukalas, Dimitris; Fragkiadaki, Persefoni; Docea, Anca O.; Alegakis, Athanasios K.; et al Discovery of potent telomerase activators: Unfolding new therapeutic and anti-aging perspectives (en anglès). Mol Med Rep, 2019 Oct; 20 (4), pp: 3701–3708. PMID: 31485647. DOI 10.3892/mmr.2019.10614 [Consulta: 16 setembre 2020].
- Rubtsova, Maria; Dontsova, Olga. Human Telomerase RNA: Telomerase Component or More? (en anglès). Biomolecules, 2020 Jun 6; 10 (6), pp: 873. PMID: 32517215. DOI 10.3390/biom10060873 [Consulta: 6 setembre 2020].
Enllaços externs
[modifica]- Activity of Telomerase Focus Medica, 2018 Nov. (en anglès)
- Acortamiento de los telómeros y telomerasa Aranda, A. 2020 Abr (en castellà)