| Substaint cheimiceach | dúil cheimiceach agus púdar inlasta |
|---|---|
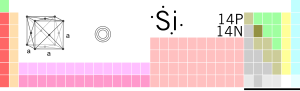
| Sileacan sa tábla peiriadach | |
| Siombail cheimiceach | Si |
| Uimhir adamhach | 14 |
| Mais adamhach | 28.085 |
| Cumraíocht leictreon | 1s² 2s² 2p⁶ 3s² 3p² agus [Ne] 3s² 3p² |
| Peiriad, Grúpa | peiread 3 grúpa 14 |
| Airíonna fisiceacha | |
| Dlús | 2.329 kg/m⁻³ |
| Leáphointe | 2,570 |
| Fiuchphointe | 4,271 |
| Leictridhiúltacht | 1.9 |
| Ga ianach | 0.26 agus 0.4 |
| Stair | |
| Aimsitheoir | Jöns Jakob Berzelius |
| Fionnachtain | 1823 |
| Eapainm | Cloch thine |
 | |
Is dúil cheimiceach é an sileacan. Is é an meáchán adamhach atá aige ná 28.0855 g/mol. Is é dúil uimhir a 14 é, agus is í an tsiombail a sheasann dó sna foirmlí ceimiceacha ná Sí. Is miotalóideach é ar dual dó ceithre nasc ceimiceacha a cheangal, agus is é an dara dúil is coitianta i sceall an Domhain. Ní bhíonn sé le fáil sa dúlra i bhfoirm dúile, ach bíonn na sileacáití - clocha ina bhfuil miotal éigin nasctha de na hiain sileacáite, a bhfuil ocsaigin agus sileacan iontu - iontach coitianta sa dúlra. D'fhéadfá a rá gur sileacáit de chineál éigin atá i bhformhór na gcloch. Comhdhúil choitianta sa nádúr í an dé-ocsaíd sileacain freisin, SiO2, nó an tsilice, atá ar fáil sa dúlra i bhfoirmeacha éagsúla cosúil leis an ngrianchloch.
Úsáidtear sileacan glan sa leictreonaic. Is leathsheoltóir é an sileacan, agus is féidir seoltacht leictreach an tsileacain a athrú go mionchruinn trí breiseáin a chur leis - is é sin, tríd an sileacan a "dhópáil", mar a deir an béarlagair. Maidir leis na sileacáití nádúrtha agus an dé-ocsaíd, is féidir gloine, ábhar ceirmeach nó ábhar tógála eile a dhéanamh díobh. Tá sileacan sna plaistigh shileacain, nó Silicone, a chuirtear faoi chíocha na mban le cuma níos cobhsaí a chur orthu, mar shampla.
Déanann an sileacan páirt thábhachtach i meitibileacht na bplandaí, ach ní bhíonn ach iarsmaí de ag teastáil ó na hainmhithe.
Is féidir comhdhúile casta a thógáil ina bhfuil slabhraí d'adaimh shileacain le fáil, ach tríd is tríd, bíonn slabhraí na n-adamh sileacain i bhfad níos laige ná na slabhraí carbóin. Mar shampla, tá na sioláin - SiH4, Si2H6 7rl - níos éagobhsaí ná na comhdhúile analógacha carbóin (na halcáin), agus is dual do na sioláin dul trí thine as a stuaim féin.
Dúil sách támh é an sileacan, ach imoibríonn sé leis na substaintí alcaileacha agus leis na halaiginí. An chuid is mó de na haigéid, áfach, ní féidir leo a dhath a dhéanamh dó, amach ó mheascáin áirithe a bhfuil aigéad nítreach agus fluairíd hidrigine iontu.
Tá trí iseatóp cobhsaí ag an sileacan: 28Si, arb é an t-iseatóp is cobhsaí (92.23 % de shileacan an dúlra), 29Si (4.67 %) agus 30Si (3.1 %). Tá iarsmaí den iseatóp radaighníomhach úd 32Si ar fáil sa dúlra freisin, nó claochlaíonn an radaíocht chosmach an t-argón go sileacan den iseatóp seo.
Déantar sileacan trí dhé-ocsaíd sileacain a théamh suas go 1,900 °C i stuafhoirnéis leictreach, agus leictreoidí carbóin á n-úsáid leis an stua leictreach a ghineadh. Nuair a bheidh an fhoirnéis sách te, tosóidh an carbón ag dí-ocsaídiú na dé-ocsaíde go sileacan, agus an carbón féin á n-ocsaídiú go dé-ocsaíd agus aonocsaíd carbóin. Fágfar an sileacan leáite thíos in íochtar na foirnéise, agus ansin, draenálfar as an bhfoirnéis é agus ligfear dó fuarú síos. An sileacan seo, tugtar sileacan den ghrád miotalóireachta air, agus bíonn sé 98 % ar íonacht. Má theastaíonn uainn sileacan níos glaine, áfach, is fearr dúinn silice a leá agus a leictrealú.
Tá criostail an tsileacain cosúil leis an diamant, is é sin, tá struchtúr ciúbach éadanláraithe acu.