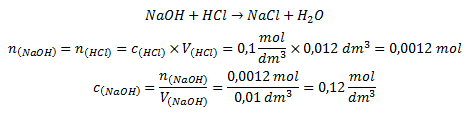Povijest titracije
Volumetrijska analiza je nastala krajem 18. stoljeća u Francuskoj. François-Henri-Antoine Descroizilles razvio je prvu birete (koja je bila slična menzuri) 1791. Joseph Louis Gay-Lussac razvio je poboljšanu verziju birete koji je uključivala pričvršćenje, a skovao riječi "pipeta" i "bireta" 1824. Veliki napredak u metodologiji i popularizaciji volumetrijske analize je dao Karl Friedrich Mohr, koji je redizajnirao birete stavljanjem spona, a napisao je prvi udžbenik na temu, Lehrbuch der chemisch-analytischen Titrirmethode (Udžbenik analitičke-kemijskih metoda titracije), objavljen 1855.
Titracijske krivulje
Titracijska krivulja je krivulja u ravnini čija je apscisa volumen titranta dodanog nakon početka titracije, a čija je y-koordinata koncentracija analita u odgovarajućem stadiju titracije (u kiselo-baznim titracijama, y-koordinata je obično pH otopine).
U acidimetriji, titracijska krivulja pokazuje snagu odgovarajuće kiseline i baze. Za jake kiseline i jake baze, krivulja će biti relativno glatka i vrlo strma blizu točke ekvivalencije. Zbog toga, mala promjena titracijskog volumena u blizini točke ekvivalencije rezultira velikom promjenom pH i mnogi indikatori su primjereni za određivanje završne točke titracije (npr lakmus, fenolftalein ili bromotimol plavo).
Ako je jedan reagens slaba kiselina ili baza i drugi jaka kiselina ili baza, titracijska krivulja je nepravilna i pH se pomiče manje s malim dodacima titranta u blizini točke ekvivalencije. Na primjer, titracijska krivulja za titraciju između octene kiseline (slaba kiselina) i natrijevog hidroksida (jaka baza) je na slici. Točka ekvivalencije je između pH 8-10, što ukazuje da je otopina bazna u točki ekvivalencije i prikladan bi bio indikator kao što je fenolftalein. Titracijske krivulje kojima odgovaraju slabe baze i jake kiseline na sličan način se ponašaju, pri čemu je otopina kisela u točki ekvivalencije i prikladan bi bio indikator kao što je metil oranž, bromtimol plavo.
Titracije između slabe kiseline i slabe baze su titracijske krivulje koje su vrlo nepravilne. Zbog toga, nije definiran prikladan indikator i pH metar se često koristi za praćenje reakcije.
Funkcije koje se koriste za opisivanje krivulja nazivaju se sigmoidalne funkcije.
Vrste titracija
Najčešće vrste kvalitativnih titracija su kiseline-bazne titracije i redoks titracije.
Kiselo-bazne titracije
Kiselo bazne titracije su titracije neutralizacije kiselina ili baza u otopini. Osim uzorka, analita, dodaje se i pH indikator. Kiselo-bazni indikator pokazuje krajnje točke titracije promjenom boje. Krajnja točka i točke ekvivalencije nisu iste jer točke ekvivalencije se određuje iz stehiometrije reakcije, a završna točka je samo promjena boje indikatora.
Pažljivim odabirom indikatora smanjit će se indikatorska pogrešku. Na primjer, ako je točka ekvivalencije pri pH 8,4, a indikator fenolftalein će se koristiti umjesto alizarin žuto. Fenolftaleina će smanjiti indikatorsku pogrešku. Kada su potrebni precizniji rezultati, ili kada su reagensi slabe kiseline i slabe baze, dobro je koristiti i pH metar ili konduktometar.
Primjer kiselobazne titracije
analit: otopina NaOH,
titrant: standardna otopina HCl
- V(HCl) = 12 ml = 0,012 dm3 (volumen upotrijebljen pri titraciji )
- c(HCl) = 0,1 mol/dm3 (tzv. standardna koncentracija)
- V(NaOH) = 10 ml = 0,01 dm3 (volumen otopine koju ispitujemo)
- c(NaOH) = ? mol/dm3 (tražena koncentracija)
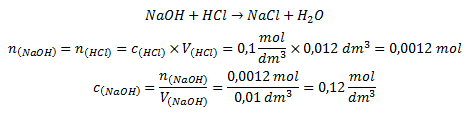
Oksido-redukcijske titracije
Redoks titracije se zasnivaju oksido-redukcijskim reakcijama između oksidacijskih sredstava i sredstava za redukciju. Potenciometar ili redoks indikator se koriste za određivanje završne točke titracije.
Postoje redoks titracije koje ne zahtijevaju indikator, zbog intenzivne boje sastojaka. Na primjer, u permanganometriji stabilna blago ružičasta boja završna je točka titracije zbog boje viška oksidans kalijeva permanganata. Čak je izraženija završna točka u jodometriji, gdje boja ide iz duboke smeđe do obezbojavanja.
Kompleksometrija
Komplexometrijske titracije oslanjaju se na tvorbu kompleksa između analita i titranta. Općenito, oni zahtijevaju specijalizirane kompleksometrijske indikatore koji čine slabe komplekse s analitom. Uobičajeni primjeri su Eriokrom crno T za titraciju kalcija i magnezija, a kelirajuće sredstvo EDTA koristiti za titraciju metalnih iona u otopini.
Određivanje završne točke titracije
Različite su metode za određivanje završne točke:
- Indikator: tvar koja mijenja boju kao odgovor na kemijske promjene. Indikator acidobazni (npr. fenolftalein) mijenja boju u ovisnosti o pH. Redox indikatori se također koriste. Kap indikatorske otopine doda se na početku u analit; završna točka je postignuta kad se promijeni boja.
- Potenciometar: Instrument koji mjeri elektrodni potencijal otopine. Koristi se za redoks titracije; potencijal radne elektrode naglo će se promijeniti kad je završna točka postignuta.
- pH metar: potenciometar s elektrodom čiji potencijal ovisi o količini H+ iona prisutnih u otopini. pH otopine se mjeri tijekom titracije, točnije je od titracije s indikatorom; završna točka će biti postignuta kada se očita nagla promjena pH.
- Vodljivost: mjerenje vodljivosti otopine. Koncentracija iona može se značajno promijeniti za vrijeme titracije, što mijenja vodljivost. (Na primjer, tijekom acidimetrije, H+ i OH- ioni će reagirati formirajući neutralnu molekulu H2O). Kako ukupna vodljivost ovisi o svim ionima prisutnih u otopini, a svi ioni ne doprinose jednako (zbog pokretljivosti i ionske jakosti), predviđanje promjene vodljivosti je teže nego što je mjerenje.
- Promjena boje: U nekim reakcijama, otopina mijenja boju bez dodanog indikatora. To se često vidi kod redoks titracija kada različita oksidacijska stanja proizvoda i reaktanta daju različite boje.
- Taloženje: Ako reakcija daje krutinu, talog se formira tijekom titracije. Klasičan primjer je reakcija između Ag+ i Cl- u obliku netopljivih soli AgCl. Mutni talozi obično čine teškoće u preciznom određivanju završne točke titracije. Da bi se to nadoknadila, taložne titracije često moraju biti rađeno kao "povratne" titracije.
- Spektroskopija: Koristi se mjerenje apsorpcije svjetlosti otopine tijekom titracije ako su spektri reaktanta, titranta i produkta, poznati. Koncentracija materijala može se odrediti pomoću Beer-ovog zakona.
- Amperometrija: Mjeri se struja proizvodena titracijskom reakcijom kao posljedica oksidacije ili redukcije analita. Završna točka se određuje kao promjena struje. Ova metoda se najčešće koristi, kada se višak titranta može smanjiti, što je u titracije halida s Ag+.
Završna točka titracije i točka ekvivalencije
Iako se točka ekvivalencije i završna točka koriste naizmjenično, oni su različiti pojmovi. Točke ekvivalencije je teoretski završetak reakcije: volumen dodanog titranta kod kojeg je broj molova titranta jednak broju molova analita, ili neki njihovi višesruki (kao u poliprotonske kiseline). Završna točka titracije je ono što se zapravo mjeri, fizičke promjene u otopini se određuju pomoću indikatora ili instrumenta.
Postoji mala razlika između završne točke i točke ekvivalencije titracije. Ova greška se naziva indikatorska pogreška, i neodrediva je.
Povratne titracije
Povratne titracije su titracija rađene u nazad; umjesto titracije originalnog uzorka, poznati suvišak standardnih reagensa je dodan u otopinu, a višak se titrira. Povratne titracije su korisne ako se završna točka povratne titracije lakše određuje nego završna točke obične titracije, kao i s reakcijama taloženja. Povratne titracije također su korisne ako su reakcije između analita i titranta vrlo spore, ili kad se analit nalazi u netopljivim krutinama.
Izvor
- Tehnički leksikon, Leksikografski zavod Miroslav Krleža; glavni urednik: Zvonimir Jakobović. Zagreb, 2007., str. 890.
- Douglas A. Skoog, Donald M. West, F. James Holler Osnove analitičke kemije, Školska knjiga, Zagreb, 1999.