
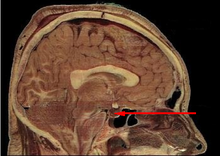
L'ipofisi (pronuncia: /iˈpɔfizi/[1]; dal greco ὑπόφυσις hypóphysis, derivato di ὑποϕύω, ὑποϕύομαι, "produrre sotto", "crescere sotto"), detta anche ghiandola pituitaria, è una ghiandola endocrina situata alla base del cranio, nella fossa ipofisaria della sella turcica dell'osso sfenoide.
Si può dividere in due lobi, strutturalmente e funzionalmente diversi, che controllano, attraverso la secrezione di numerosi ormoni, l'attività endocrina e metabolica di tutto l'organismo:
- il lobo anteriore (adenoipofisi), nello sviluppo embrionale si forma per invaginazione dell'ectoderma dello stomodeo (membrana faringea), la struttura transitoria originante l'adenoipofisi viene detta "tasca di Rathke";
- il lobo posteriore (neuroipofisi), formazione neuro-ectodermica diencefalica, deriva da un'evaginazione del diencefalo.
Essi sono divisi da una pars intermedia, piccola e poco vascolarizzata.
Anatomia
[modifica | modifica wikitesto]La ghiandola si trova postero-inferiormente al chiasma ottico. È di dimensioni abbastanza piccole e pesa non più di 0,9 g. È separata dall'encefalo da una porzione della dura madre (il "diaframma della sella"), che la sovrasta ad ombrello e mediante un peduncolo vascolo-nervoso comunica con l'ipotalamo, che regola attraverso altre sostanze ormonali l'ipofisi stessa. Intorno alla sella turcica si trovano i seni cavernosi da cui defluiscono le carotidi interne e i nervi cranici III, IV, V e VI; è facile immaginare che alterazioni a carico dell'ipofisi possono quindi causare diversi effetti secondari sulla funzione visiva (compromissione del chiasma), vascolare, neurologica.
Per definire la loro azione, secondo il metodo classico della fisiologia sperimentale, si è proceduto all'asportazione chirurgica della ghiandola in animali da laboratorio. Gli effetti dell'ablazione del lobo anteriore sono in parte caratterizzati dalla diminuita attività delle altre ghiandole endocrine: la tiroide si atrofizza, e così pure le surreni e le gonadi, con scomparsa della spermatogenesi nel maschio e dell'ovulazione nella femmina; diminuisce la sensibilità all'insulina per la compromissione delle isole pancreatiche, e insorge una lieve forma di diabete insipido. L'ipofisectomia comporta inoltre arresto dello sviluppo somatico negli animali giovani, con alterazioni scheletriche e muscolari. Queste osservazioni hanno permesso di individuare i diversi ormoni secreti dall'ipofisi.
Microanatomia
[modifica | modifica wikitesto]L’adenoipofisi contiene cellule cromofobe e cromofile, organizzate in nidi e cordoni; le cromofile si dividono in acidofile eosinofile (colore rosato se trattate con EE) e basofile (colore blu/viola in EE). Le acidofile sono più frequenti (nell’adenoipofisi propriamente detta) e di dimensioni minori, includono: somatotrope (produzione di GF) e lattotrope (PRL). Le basofile, al contrario, constano di tireotrope (TSH), corticotrope (ACTH) e gonadotrope (LH ed FSH). Nella sua azione secernente endocrina, l'adenoipofisi viene condizionata dal rilascio di ormoni ipotalamici (ad opera dei neuroni parvocellulari ipotalamici, parte della porzione neurosecernente del diencefalo): trattasi di diadi formate da un messaggero chimico stimolante la secrezione di un determinato ormone adenoipofisario ("releasing hormone", RH) e da un suo antagonista, con significato inibitorio ("inhibiting hormone", IH).
RH e IH vengono trasportati lungo i brevi assoni amielinici dei neuroni parvicellulari e rilasciati nel plesso capillare primario (mandato dall’arteria ipofisaria superiore). Tali molecole seguono il circolo portale ipotalamo-ipofisario: scendono lungo le vene superficiali del peduncolo ipofisario e terminano così nel plesso capillare secondario, raggiungendo l'adenoipofisi.
La neuroipofisi viene costituita dagli assoni amielinici dei neuroni magnocellulari dei nuclei ipotalamici paraventricolare e sopraottico, al microscopio ottico risulta scarsamente colorabile, intercalati tra le fibre nervose si individuano i nuclei dei pituiciti: cellule gliali specializzate. Si compone (in senso cranio-caudale) di: eminenza mediana, infundibolo e lobo della neuroipofisi (neuroipofisi propriamente detta), dove terminano gli assoni magnocellulari.
L’adenoipofisi, invece, è data dalla successione in senso cado-craniale di:
- Pars distale (adenoipofisi propriamente detta): prevalgono i nidi sui cordoni, le cellule sono principalmente acidofile, ivi si localizzano: somatotrope, lattotrope, tireotrope, corticotrope e gonadotrope.
- Pars intermedia: accollata alla neuroipofisi propriamente detta, separata dalla parte distale adenoipofisaria dalla fessura ipofisaria, presenta prevalenza di cellule basofile, eventualmente (in situazioni patologiche) inframezzate da “cisti di Rathke". Vi si trovano cellule melanotrope (producono MSH), lattotrope e rilascianti beta-endorfine. Pare sede anche di processi cognitivi ed emozionali.
- Pars tuberale/infundibolare: cordoni predominanti, vi si individuano cellule gonadotrope, tireotrope e macrofagiche.
Ormoni secreti dall'ipofisi
[modifica | modifica wikitesto]Ormoni agenti su organi e cellule bersaglio
[modifica | modifica wikitesto]Sono prodotti dalle cellule acidofile dell'adenoipofisi
- Dalle cellule alfa l'ormone somatotropo (GH, meno comunemente STH) agisce direttamente sui tessuti ed è indipendente dall'attività delle altre ghiandole endocrine; stimola la deposizione del calcio nel tessuto osseo e la proliferazione delle cellule cartilaginee, aumenta la massa dei muscoli scheletrici e stimola la sintesi proteica. È detto anche ormone della crescita e la sua mancanza causa l'arresto dello sviluppo staturale e ponderale dell'individuo.
- Dalle cellule epsilon la prolattina (PRL) agisce sulla ghiandola mammaria stimolando la secrezione di latte dopo il parto.
- L'ormone melanotropo (MSH) ha effetto trofico sui melanociti, responsabili della pigmentazione della pelle. A differenza degli altri ormoni ipofisiari della sua classe questo è prodotto dalle cellule basofile dell'adenoipofisi. Le cellule melanotrope si concentrano nella parte intermedia dell'ipofisi.
Ormoni trofici
[modifica | modifica wikitesto]Gli ormoni trofici sono ormoni glicoproteici (PAS positivi) che agiscono su altre ghiandole endocrine, e sono prodotti dalle cellule basofile:
- Dalle cellule delta l'ormone tireotropo (TSH) agisce sulla tiroide, favorendo la liberazione degli ormoni che questa produce (tiroxina e triiodotironina).
- L'ormone adrenocorticotropo (ACTH) determina a sua volta la sintesi e la secrezione molto rapida degli ormoni della corteccia surrenale e stimola il metabolismo lipidico.
- Dalle cellule beta e gamma rispettivamente l'ormone follicolo-stimolante (FSH) e l'ormone luteinizzante (LH) sono invece gonadotropi (agiscono cioè sulle gonadi); nelle ovaie il primo stimola la formazione dei follicoli e la secrezione dei loro ormoni (estrogeni), il secondo la formazione del corpo luteo e la secrezione dell'ormone corrispondente, il progesterone; nel testicolo, l'LH agisce invece sulle cellule interstiziali (e viene perciò anche contraddistinto con la sigla ICSH), promuovendo la spermatogenesi e la secrezione dell'ormone testicolare (testosterone), mentre l'FSH favorisce la sintesi (operata dalle cellule del Sertoli) della proteina legante gli androgeni (ABP) che lega il testosterone, portandolo all'interno dei tubuli seminiferi contorti e attivando così gli spermatozoi.
La porzione posteriore dell’ipofisi detta Neuroipofisi, rilascia due neuropeptidi prodotti a monte dell’asse ipotalamo-ipofisario dai nuclei ipotalamici: Ossitocina e ADH. L’Ossitocina viene prodotta e rilasciata durante l’atto sessuale, il parto e l’allattamento, trattasi di un vasodilatatore della muscolatura liscia usato anche in terapia sistemica per indurre il parto. Diverse ricerche individuano nell’Ossitocina peculiarità legate alla sfera affettiva e relazionale. Determina infatti meccanismi di attaccamento affettivo nei mammiferi dovuti al coinvolgimento anatomico e funzionale del Sistema Limbico e delle altre strutture Diencefaliche.
L’ADH o Ormone antidiuretico o Vasopressina determina la ritenzione di liquidi e l’aumento della volemia. L’azione di questo ormone si estrinseca nel dotto collettore renale, dove induce l’espressione di AQP-2 con conseguente riassorbimento di acqua. È rilasciata in caso di ipernatriemia e disidratazione ipertonica, ma anche nello shock ed in stati di ipoperfusione del rene in qualità di effettore del sistema renina-angiotensina-aldosterone. L’ADH è inibito principalmente negli stati ipertensivi, in caso di aumento della GFR e da sostanze specifiche tra cui l’alcool etilico.
Patologia
[modifica | modifica wikitesto]Se questi meccanismi di regolazione sono alterati, o se l'ipofisi è in qualche modo danneggiata, si può verificare un'eccessiva produzione di ormoni (iperpituitarismo) o una loro carenza (ipopituitarismo).
- L'ipopituitarismo, in soggetti giovani, si manifesta essenzialmente con il nanismo ipofisario che dipende da deficienza di ormone somatotropo; se la deficienza riguarda invece l'ACTH si ha insufficienza surrenale, con diminuita capacità dell'organismo di rispondere alle infezioni e agli stress.
- L'iperpituitarismo, dovuto in genere ai tumori all'adenoipofisi, riguarda anch'esso gli ormoni somatotropo e corticotropo. L'eccesso di ormone somatotropo determina due fenomeni diversi: se l'ipersecrezione esordisce prima della maturazione delle ossa lunghe, lo scheletro continua ad accrescersi dando luogo alla caratteristica sindrome del gigantismo (alcuni giovani pazienti raggiungono altezze di 2,10-2,40 m); se invece la malattia insorge dopo la maturazione dell'organismo e dello scheletro, si manifesta acromegalia (aumento delle dimensioni dei segmenti ossei periferici) con dorso ricurvo, mascella prominente, mani e piedi enormemente sviluppati. Quando l'iperpituitarismo riguarda l'ormone corticotropo (ACTH), si verifica una iperplasia dei surreni (sindrome di Cushing), che dà luogo alla caratteristica faccia a "luna piena", addome prominente, acne, irsutismo (vedi ipertricosi) e assottigliamento delle ossa.[2][3][4][5][6][7][8][9]
Note
[modifica | modifica wikitesto]- ^ Luciano Canepari, ipofisi, in Il DiPI: dizionario di pronuncia italiana, Bologna, Zanichelli, 1999, ISBN 88-08-09344-1.
- ^ Pietro Mortini, Lina Raffaella Barzaghi e Marco Losa, Microsurgical therapy of pituitary adenomas, in Endocrine, vol. 59, n. 1, 2018 Jan, pp. 72-81, DOI:10.1007/s12020-017-1458-3, PMID 29067608.
- ^ Alfio Spina, Marco Losa e Pietro Mortini, Pituitary adenomas in elderly patients: clinical and surgical outcome analysis in a large series, in Endocrine, vol. 65, n. 3, pp. 637-645, DOI:10.1007/s12020-019-01959-0, PMID 31209675.
- ^ Marco Losa, Carmine Antonio Donofrio e Pietro Mortini, Pretreatment with somatostatin analogs does not affect the anesthesiologic management of patients with acromegaly, in Pituitary, vol. 22, n. 2, DOI:10.1007/s11102-019-00952-0, PMID 30826981.
- ^ Lina Raffaella Barzaghi, Marco Losa e Pietro Mortini, Pediatric Pituitary Adenomas: Early and Long-Term Surgical Outcome in a Series of 85 Consecutive Patients, in Neurosurgery, vol. 85, n. 1, DOI:10.1093/neuros/nyy204, PMID 29790934.
- ^ S Melmed, A Giustina e Acromegaly Consensus Group, Guidelines for acromegaly management: an update, in J Clin Endocrinol Metab, vol. 94, n. 5, DOI:10.1210/jc.2008-2421, PMID 19208732.
- ^ Andrea Giustina, Pietro Mortini e Shlomo Melmed, Multidisciplinary management of acromegaly: A consensus, in Rev Endocr Metab Disord, vol. 21, n. 4, Dec 2020, pp. 667-678, DOI:10.1007/s11154-020-09588-z.
- ^ Felipe F Casanueva, Pietro Mortini e Andrea Giustina, Criteria for the definition of Pituitary Tumor Centers of Excellence (PTCOE): A Pituitary Society Statement, in Pituitary, vol. 20, n. 5, pp. 489-498, DOI:10.1007/s11102-017-0838-2, PMID PMC5606938.
- ^ Andrea Giustina, Pietro Mortini e Shlomo Melmed, A Consensus on the Diagnosis and Treatment of Acromegaly Comorbidities: An Update, in J Clin Endocrinol Metab, vol. 105, n. 4, 2020 Apr, DOI:10.1210/clinem/dgz096, PMID 31606735.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «ipofisi»
Wikizionario contiene il lemma di dizionario «ipofisi» Wikimedia Commons contiene immagini o altri file su ipofisi
Wikimedia Commons contiene immagini o altri file su ipofisi
Collegamenti esterni
[modifica | modifica wikitesto]- ipofisi, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- ipòfiṡi, su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- (EN) Charles H. Emerson, pituitary gland, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 11989 · LCCN (EN) sh85102519 · GND (DE) 4026389-7 · BNF (FR) cb119413718 (data) · J9U (EN, HE) 987007550809305171 · NDL (EN, JA) 00565139 |
|---|
