| Neodimio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
praseodimio ← neodimio → promezio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | neodimio, Nd, 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | lantanidi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | —, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 6 800 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 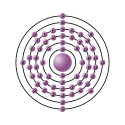 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 5I4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 144,24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 181 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 201±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Xe]4f46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 18, 22, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 3 (debolmente basico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 1 297 K (1 024 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 3 347 K (3 074 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 20,59×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 273 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 7,14 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 6,03×10−3 Pa a 2890 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 2330 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,14 (scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 190 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 1,57×106/m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 16,5 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 533,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 040 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 130 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 3 900 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il neodimio è l'elemento chimico di numero atomico 60 e il suo simbolo è Nd.
Caratteristiche
[modifica | modifica wikitesto]Il neodimio è un metallo appartenente al gruppo delle terre rare, o lantanidi, presente nella lega chiamata mischmetal fino al 18%.
È un metallo d'aspetto argenteo e lucente; tuttavia, essendo uno dei lantanidi più reattivi, si ossida rapidamente all'aria coprendosi di una patina di ossido che, desquamandosi, espone all'azione ossidante dell'aria nuovi strati di metallo.
Applicazioni
[modifica | modifica wikitesto]Tra gli usi del neodimio si annoverano:
- Come componente del didimio, utilizzato per la colorazione degli occhiali e degli schermi per saldatori.
- Negli auricolari ergonomici in cui la presenza di magneti in neodimio offre una qualità sonora eccellente.
- L'utilizzo come colorante per vetri consente di ottenere delicate tonalità che variano dal violetto al rosso-vino sino a tonalità calde di grigio. L'assorbimento di tali vetri presenta picchi di assorbimento particolarmente stretti. Questi vetri sono utilizzati per produrre filtri per osservazioni astronomiche, calibrando le bande dello spettro di assorbimento. Il neodimio consente di compensare il colore verde dei vetri, impartito dal ferro come contaminante.
- Come drogante viene utilizzato in alcuni materiali trasparenti impiegati nei laser all'infrarosso (1054-1064 nm); fra questi, il granato di ittrio e alluminio (Nd:YAG), il fluoruro di ittrio e litio (Nd: YLF), il vanadato di ittrio (Nd: YVO) e nei vetri al neodimio (Nd: glass). Questi ultimi sono usati per costruire i laser a impulsi più potenti del mondo, in grado di fornire potenze dell'ordine dei TW per ogni singolo impulso; gruppi di questi laser vengono usati negli esperimenti di fusione nucleare per ottenere il confinamento inerziale dell'idrogeno.
- I sali di neodimio sono usati come coloranti per smalti.
- Il neodimio viene utilizzato per produrre magneti permanenti Nd2Fe14B ad elevata coercitività. Questi materiali sono meno costosi dei magneti al samario-cobalto e vengono anche utilizzati nella produzione di auricolari.
- Probabilmente a causa di affinità con Ca2+, è stato citato l'utilizzo di Nd3+ come agente di crescita per le piante:[1] in Cina è frequente l'utilizzo di composti delle terre rare come fertilizzanti.
- Viene utilizzato per la produzione di altoparlanti di qualità per riprodurre fedelmente le frequenze più alte, ad esempio i tweeter al neodimio si caratterizzano per l'elevata brillantezza del suono.
- Viene utilizzato nella produzione di componenti magnetici di diversi tipi di microfoni professionali per la sua particolare struttura magnetica che assicura una maggiore sensibilità, un miglior rapporto segnale/rumore e una gamma estesa delle frequenze con "alti" limpidi.
Storia
[modifica | modifica wikitesto]Il neodimio è stato scoperto dal chimico austriaco barone Carl Auer von Welsbach a Vienna nel 1885. Auer von Welsbach tramite un'analisi spettroscopica individuò il neodimio nel didimio insieme al praseodimio, tuttavia l'elemento non fu isolato in forma pura fino al 1925. Il nome deriva dalle parole greche neos, nuovo, e didimos, gemello.
Oggi il neodimio viene ottenuto tramite un processo di scambio ionico dalle sabbie di monazite ((Ce,La,Th,Nd,Y)PO4), un minerale ricco di elementi appartenenti alla classe dei lantanidi, e per elettrolisi dei suoi sali alogenati.
Disponibilità
[modifica | modifica wikitesto]Il neodimio non si trova mai in natura allo stato nativo; si rinviene invece in minerali quali la sabbia di monazite ((Ce,La,Th,Nd,Y)PO4) e la bastnasite ((Ce,La,Th,Nd,Y)(CO3)F), nonché nel mischmetal.
La sua separazione dalle altre terre rare è piuttosto difficoltosa.
Composti
[modifica | modifica wikitesto]Tra i composti del neodimio si hanno
- NdCl2; NdCl3
- NdBr2; NdBr3
- NdI2; NdI3
Solfuri
- NdS; Nd2S3
Selenuri
- NdSe
Tellururi
- NdTe; Nd2Te3
- NdN
Isotopi
[modifica | modifica wikitesto]Il neodimio in natura si presenta come una miscela di cinque isotopi stabili, 142Nd, 143Nd, 145Nd, 146Nd e 148Nd, di cui il 142 è il più abbondante (27,2%), e due isotopi radioattivi, 144Nd e 150Nd.
Gli isotopi radioattivi del neodimio sono in totale 31 ed i più stabili sono 150Nd, con un'emivita di 1,1×1019anni, 144Nd (2,29×1015anni) e 147Nd (10,98 giorni). Gli altri isotopi hanno emivite inferiori a 3,38 giorni e la maggior parte di essi inferiore ai 71 secondi.
Questo elemento presenta anche 4 stati metastabili, i più stabili sono 139mNd (emivita di 5,5 ore), 135mNd (5,5 minuti) e 141mNd (62,0 secondi).
La principale modalità di decadimento radioattivo degli isotopi fino a 142Nd è la cattura elettronica con trasformazione in isotopi del praseodimio; per gli isotopi di massa superiore è il decadimento beta con trasformazione in isotopi del promezio.
Precauzioni
[modifica | modifica wikitesto]La polvere di neodimio metallico è reattiva all'aria e può incendiarsi spontaneamente.
Come per tutti i lantanidi, i composti del neodimio hanno una tossicità medio-bassa, tuttavia non sono stati condotti studi specifici sulla tossicità del neodimio. La polvere di neodimio ed i suoi sali sono molto irritanti per gli occhi e le mucose e moderatamente irritanti per la pelle. L'inalazione delle polveri può causare embolie polmonari ed un'esposizione prolungata danneggia il fegato. Il neodimio ha anche un effetto anticoagulante sul sangue, specie se somministrato per via endovenosa.
Magneti al neodimio sono stati testati per la realizzazione di supporti per la riparazione delle ossa fratturate, ma problemi di biocompatibilità hanno impedito la diffusione della tecnica.
Note
[modifica | modifica wikitesto]- ^ (EN) Youzhang Wei e Xiaobo Zhou, The Effect of Neodymium (Nd3+) on Some Physiological Activities in Oilseed Rape during Calcium (Ca2+) Starvation, su regional.org.au, Zhejiang, Department of Soil Science & Agro-chemistry.
Bibliografia
[modifica | modifica wikitesto]- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «neodimio»
Wikizionario contiene il lemma di dizionario «neodimio» Wikimedia Commons contiene immagini o altri file su neodimio
Wikimedia Commons contiene immagini o altri file su neodimio
Collegamenti esterni
[modifica | modifica wikitesto]- neodimio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) neodymium / neodymium alloy, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Neodimio, su periodic.lanl.gov, Los Alamos National Laboratory. URL consultato il 30 marzo 2005 (archiviato dall'url originale il 19 dicembre 2008).
- (EN) Neodimio, su WebElements.com. URL consultato l'8 novembre 2022 (archiviato dall'url originale il 4 marzo 2016).
- (EN) Neodimio, su EnvironmentalChemistry.com.
- (EN) It's Elemental – Neodymium, su education.jlab.org.
 (EN, IT) Magneti in Neodimio: la Legge di Lenz all'opera, su YouTube.
(EN, IT) Magneti in Neodimio: la Legge di Lenz all'opera, su YouTube.
| Controllo di autorità | Thesaurus BNCF 37261 · LCCN (EN) sh85090754 · GND (DE) 4171432-5 · J9U (EN, HE) 987007563184005171 |
|---|

