| Polietilene | |
|---|---|
 | |
| Abbreviazioni | |
| PE | |
| Numero CAS | |
| Caratteristiche generali | |
| Composizione | (C2H4)n |
| Aspetto | solido bianco in varie forme |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,88-0,96 |
| Temperatura di fusione (K) | 115-140 °C (388,15 - 413,15 K) |
| Indicazioni di sicurezza | |
| Flash point (K) | 341 °C (614,15 K) |
| Temperatura di autoignizione (K) | 330-410 °C (603,15 - 683,15 K) |
| Simboli di rischio chimico | |
| Codice di riciclaggio | |
| 02 PE-HD 04 PE-LD  
| |
Il polietilene o politene (in sigla PE), è il più semplice dei polimeri sintetici ed è la più comune fra le materie plastiche.
Ha formula chimica (-C2H4-)n dove il grado di polimerizzazione n può arrivare ad alcuni milioni. Le catene sono di lunghezza variabile e più o meno ramificate.
Il polietilene è una resina termoplastica, si presenta come un solido trasparente (se amorfo) o bianco (se cristallino) con ottime proprietà isolanti e stabilità chimica.
È una delle materie plastiche più versatili ed economiche. Gli usi più comuni sono come isolante per cavi elettrici, film per l'agricoltura, borse e buste di plastica, contenitori di vario tipo, tubazioni, strato interno di contenitori asettici per liquidi alimentari e molti altri.
Storia
[modifica | modifica wikitesto]Il polietilene è stato sintetizzato per la prima volta accidentalmente dal chimico tedesco Hans von Pechmann nel 1898, mentre riscaldava del diazometano. I suoi colleghi Eugen Bamberger e Friedrich Tschirner analizzarono la sostanza bianca simile a cera sulle pareti del contenitore, scoprirono che conteneva delle lunghe catene di -CH2-, e decisero di chiamarla polimetilene.
La prima sintesi industriale fu ottenuta (ancora accidentalmente) da Eric Fawcett e Reginald Gibson alla ICI Chemicals nel 1933. Il polietilene si era formato applicando una pressione di diverse centinaia di atmosfere su un contenitore contenente etilene e benzaldeide; anche stavolta notarono un materiale simile a cera sulle pareti del contenitore. La reazione era stata tuttavia innescata da tracce di ossigeno contenute nel contenitore e non fu possibile replicarla con successo fino al 1935, quando un altro chimico ICI, Michael Perrin, sviluppò una sintesi industriale riproducibile per la sintesi del polietilene a bassa densità (LDPE).[1] La prima tonnellata di materiale dimostrò che questo aveva qualità impareggiabili come isolante elettrico, e nell'agosto del 1939 ebbe inizio la produzione industriale, che fu interamente assorbita dalle necessità belliche (in particolare nelle tecniche collegate al radar).[2] Finita la guerra il polietilene rischiò di scomparire dai prodotti della ICI, ma i risultati delle ricerche su possibili nuove applicazioni dimostrarono che era assai più versatile di quanto si fosse pensato.
Il successivo traguardo nella sintesi del polietilene è stato lo sviluppo di numerosi catalizzatori che ne hanno permesso la sintesi a temperature e pressioni più blande. Il primo di questi era basato sul biossido di cromo, fu scoperto nel 1951 da Robert Banks e John Paul Hogan alla Phillips Petroleum. Nel 1953, il chimico tedesco Karl Ziegler sviluppò un sistema catalitico basato su alogenuri di titanio e composti organici dell'alluminio che lavoravano a condizioni ancora più basse dei catalizzatori Phillips.[2] Questi ultimi, tuttavia, erano meno costosi e più facilmente maneggiabili; entrambi i sistemi vennero quindi usati nella sintesi industriale per la produzione di HDPE.
La catalisi di tipo Phillips ebbe inizialmente problemi nella sintesi di HDPE di qualità uniforme, e gli impianti che la utilizzavano riempirono i loro magazzini di prodotto che non rispettava le specifiche. Il collasso finanziario fu evitato nel 1957, quando prese piede negli Stati Uniti un anello di polietilene colorato, l'hula hoop.[2]
Un terzo sistema catalitico, basato sui metalloceni, fu scoperto nel 1976 in Germania da Walter Kaminsky e Hansjörg Sinn. Le catalisi a metalloceni e quella Ziegler hanno entrambe dimostrato un'ottima flessibilità nella sintesi di miscele di etene e alfa-olefine gettando le basi della attuale vasta gamma di polietilene. Alcune di queste resine, come la fibra Dyneema, hanno cominciato a rimpiazzare materiali quali il kevlar laddove sono richieste eccellenti proprietà meccaniche di resistenza a trazione.
Classificazione del polietilene
[modifica | modifica wikitesto]
In base alla distribuzione dei pesi molecolari e al grado di ramificazione si ottengono tipi di polietilene con proprietà e usi differenti:
- Polietilene ad altissimo peso molecolare (UHMWPE): è un polietilene con peso molecolare medio compreso tra 3×106 e 6×106 u (secondo lo standard ASTM D4020).[3] Ne risulta un materiale con catene ben impaccate nella struttura cristallina e molto resistente. Questo tipo di polietilene viene sintetizzato attraverso la polimerizzazione per coordinazione con metalloceni. Le particolari proprietà meccaniche lo rendono adatto, a differenza degli altri tipi più comuni di polietilene, a impieghi particolari, come ad esempio protesi e giubbotti antiproiettile.
- Polietilene ad alta densità (HDPE) o (PEAD): è un polietilene poco ramificato,[4] ha quindi forze intermolecolari elevate e maggiore rigidezza rispetto al polietilene a bassa densità; viene generalmente sintetizzato attraverso polimerizzazione per coordinazione con un sistema catalitico di tipo Ziegler-Natta.
- Polietilene a bassa densità (LDPE): è molto più ramificato dell'HDPE, è quindi un materiale più duttile e meno rigido, viene generalmente sintetizzato attraverso polimerizzazione radicalica.
- Polietilene a media densità (MDPE): è caratterizzato da percentuali inferiori di catene ramificate rispetto al polietilene a bassa densità (LDPE).
- Polietilene lineare a bassa densità (LLDPE): è sostanzialmente polietilene lineare dotato di un numero significativo di ramificazioni corte; viene normalmente ottenuto per polimerizzazione di una miscela di etene e α-olefine (butene, esene, ottene) con catalisi di tipo Ziegler-Natta.
- Polietilene espanso: è un polietilene che tramite un processo fisico-chimico viene reso poroso, leggero e morbido.
Sintesi
[modifica | modifica wikitesto]Il polietilene si sintetizza a partire dall'etilene secondo la reazione:La molecola dell'etilene è caratterizzata dal doppio legame fra gli atomi di carbonio che la rende particolarmente stabile; per tale motivo la reazione di polimerizzazione necessita di condizioni di reazione particolari.
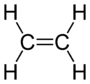
Per la produzione industriale le possibilità sono:
- Polimerizzazione radicalica (o procedimento ad alta pressione): alte temperature (circa 80-300 °C), alte pressioni (circa 1.000-3.000 bar) e presenza di iniziatori radicalici (come ad esempio ossigeno o perossidi).[5] Questo processo viene sfruttato per produrre polietilene a bassa e media densità.[5]
- Polimerizzazione per coordinazione (o procedimento a bassa pressione): con l'uso di catalizzatori a base di metalli di transizione (ad esempio sistemi di catalisi Ziegler-Natta o catalizzatori di Phillips).[4] Questo processo si utilizza per produrre polietilene ad alta densità.[4]
- Polimerizzazione con catalizzatori metallocenici, di prima e di seconda generazione con processo in fase gas, e soluzione.
Schema di processo
[modifica | modifica wikitesto]
Applicazioni
[modifica | modifica wikitesto]

Uno degli usi classici del polietilene è la fabbricazione, mediante estrusione e successive lavorazioni, dei sacchetti comunemente detti "di plastica",
Viene inoltre impiegato per la creazione del "film estensibile" e del "film a bolle d'aria" (o pluriball).
Altri impieghi:[6]
- Impermeabilizzazioni edili generali con geomembrana in HDPE;
- rivestimento interno di confezioni in cartone per alimenti (ad esempio quelle del latte);
- flaconi per detersivi o alimenti;
- giocattoli;
- pellicole alimentari;
- tappi in plastica;
- tubi per il trasporto di acqua e gas naturale;
- rivestimento di cavi elettrici e telefonici;
- palloni stratosferici;
- mobili per il giardino (Hularo);
- reti di recinzione, reti anti-grandine, reti per agricoltura, pesca e sicurezza sul lavoro
- inserti per protesi del ginocchio.
-
Busta in polietilene
-
Flacone in polietilene
-
Barriera provvisoria componibile "New-Jersey" in polietilene
-
Elemento di imballaggio in polietilene
-
Pallone sonda in polietilene
-
Tubi in polietilene
Note
[modifica | modifica wikitesto]- ^ Devis Bellucci, Materiali per la vita: le incredibili storie dei biomateriali che riparano il nostro corpo, Torino, Bollati Boringhieri, 2002, p. 90, ISBN 978-88-339-3778-6.
- ^ a b c (EN) The Story of Polythene
- ^ Ullmann's, cap. 1.2.4.
- ^ a b c Villavecchia, p. 2517.
- ^ a b Villavecchia, pp. 2516-2517.
- ^ Ullmann's, cap. 1.6.
Bibliografia
[modifica | modifica wikitesto]- (EN) Kenneth S. Whiteley, T. Geoffrey Heggs, Hartmut Koch, Ralph L. Mawer, Wolfgang Immel, Polyolefins [collegamento interrotto], in Ullmann's Encyclopedia of Industrial Chemistry, 2000, DOI:10.1002/14356007.a21_487.
- Vittorio Villavecchia, Gino Eigenmann, Ivo Ubaldini, Nuovo dizionario di merceologia e chimica applicata, Volume 5, Hoepli editore, 1975, ISBN 88-203-0532-1.
- (EN) Andrew J. Peacock, Handbook of polyethylene: structures, properties, and applications, Volume 57 di Plastics engineering, CRC Press, 2000, ISBN 0-8247-9546-6.
- (EN) John J. Ploskonka, Ray A. Gsell, Harvey L. Stein, Characterization and Properties of Ultra-high Molecular Weight Polyethylene, ASTM International, 1998, ISBN 0-8031-2482-1.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «polietilene»
Wikizionario contiene il lemma di dizionario «polietilene» Wikimedia Commons contiene immagini o altri file sul polietilene
Wikimedia Commons contiene immagini o altri file sul polietilene
Collegamenti esterni
[modifica | modifica wikitesto]- Polietilene, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Polietilène, su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- polietilène, su sapere.it, De Agostini.
- Polietilene, in Dizionario di Economia e Finanza, Istituto dell'Enciclopedia Italiana, 2012.
- (EN) polyethylene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Polyethylene, su Open Library, Internet Archive.
- Polietilene, in Grande Dizionario di Italiano, Garzanti Linguistica.
- (EN) The manufacture of polyethylene (PDF), su nzic.org.nz. URL consultato il 29 aprile 2010 (archiviato dall'url originale il 25 maggio 2010).
- (EN) Polyethylene Bags (PDF) [collegamento interrotto], su uwsp.edu.
| Controllo di autorità | J9U (EN, HE) 987007563261305171 · NDL (EN, JA) 00569150 |
|---|


![{\displaystyle {\ce {n (CH2=CH2)-> [-CH2-CH2-]_n))}](https://wikimedia.org/api/rest_v1/media/math/render/svg/96c3452d097b24bc6bcdf567eb1a0686d2cfd44d)






